Konfigurasi elektron dalam mekanika kuantum merupakan salah satu aspek penting dalam memahami struktur atom dan sifat-sifat kimia dari suatu unsur. Dalam ilmu fisika dan kimia, konfigurasi elektron merujuk pada cara elektron disusun di dalam orbital-orbital atom, yang menentukan sifat reaktivitas, ikatan kimia, dan stabilitas molekul. Konsep ini sangat relevan dengan teori mekanika kuantum, yang menjelaskan perilaku partikel subatomik seperti elektron dengan menggunakan prinsip-prinsip matematis dan probabilistik.
Pengertian konfigurasi elektron dalam mekanika kuantum tidak hanya berbicara tentang posisi elektron, tetapi juga bagaimana mereka berinteraksi dengan medan elektromagnetik dan bagaimana mereka terdistribusi dalam ruang tiga dimensi. Mekanika kuantum menggantikan model atom Bohr yang lebih klasik, karena mampu menjelaskan fenomena seperti efek Zeeman, spektrum emisi atom, dan kestabilan molekul. Dengan demikian, pemahaman tentang konfigurasi elektron dalam konteks mekanika kuantum menjadi dasar untuk memahami berbagai fenomena fisika dan kimia modern.
Dalam artikel ini, kita akan membahas secara mendalam tentang konfigurasi elektron dalam mekanika kuantum, termasuk aturan-aturan yang digunakan dalam menentukan penempatan elektron, serta bagaimana konfigurasi ini mempengaruhi sifat-sifat kimia suatu elemen. Artikel ini dirancang untuk memberikan informasi yang akurat dan mudah dipahami, baik bagi siswa, guru, maupun penggemar ilmu pengetahuan.
Pengertian Konfigurasi Elektron dalam Mekanika Kuantum
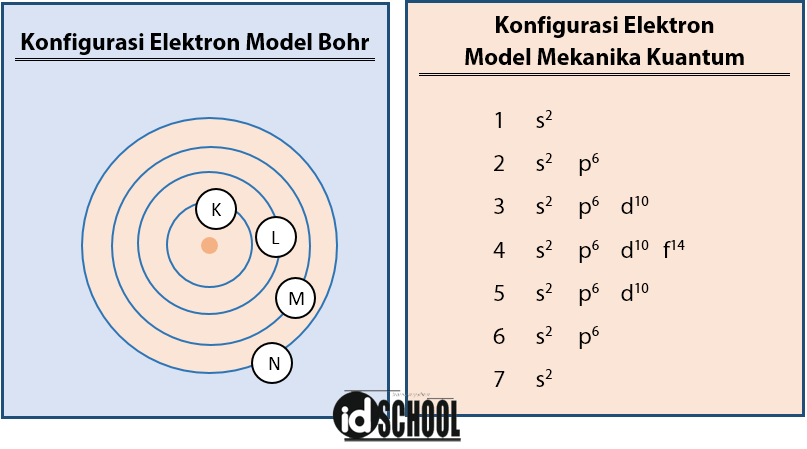
Konfigurasi elektron adalah susunan atau distribusi elektron dalam atom berdasarkan tingkat energi, orbital, dan subkulit. Dalam mekanika kuantum, elektron tidak bergerak dalam orbit tetap seperti yang dinyatakan oleh model atom Bohr, melainkan berada dalam daerah probabilitas tertentu yang disebut orbital. Orbital adalah wilayah di sekitar inti atom di mana kemungkinan besar elektron dapat ditemukan.
Dalam mekanika kuantum, setiap elektron memiliki empat bilangan kuantum yang menentukan posisinya dalam atom:
1. Bilangan kuantum utama (n): Menunjukkan tingkat energi utama atau kulit elektron.
2. Bilangan kuantum azimuth (l): Menentukan bentuk orbital (s, p, d, f).
3. Bilangan kuantum magnetik (m): Menunjukkan orientasi orbital dalam ruang.
4. Bilangan kuantum spin (s): Menunjukkan arah rotasi elektron.
Konfigurasi elektron dalam mekanika kuantum mengikuti aturan-aturan spesifik, seperti Aturan Aufbau, Larangan Pauli, dan Kaidah Hund, yang memastikan bahwa elektron menempati orbital dengan cara yang paling stabil dan sesuai dengan prinsip-prinsip kuantum.
Aturan Penentuan Konfigurasi Elektron
Untuk menentukan konfigurasi elektron dalam mekanika kuantum, ada beberapa aturan penting yang harus dipatuhi:
1. Aturan Aufbau
Aturan ini menyatakan bahwa elektron akan mengisi orbital dengan tingkat energi terendah terlebih dahulu sebelum beralih ke tingkat energi yang lebih tinggi. Urutan pengisian orbital mengikuti diagram energi yang dikenal sebagai diagram Moeller atau diagram aufbau. Contohnya:
– 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
Setiap subkulit memiliki jumlah maksimum elektron yang bisa ditampung:
– Subkulit s: 2 elektron
– Subkulit p: 6 elektron
– Subkulit d: 10 elektron
– Subkulit f: 14 elektron
2. Larangan Pauli
Larangan Pauli menyatakan bahwa tidak boleh ada dua elektron dalam satu atom yang memiliki keempat bilangan kuantum yang sama. Artinya, setiap orbital hanya dapat menampung maksimal dua elektron dengan spin yang berlawanan (salah satu arah ke atas dan satunya ke bawah).
3. Kaidah Hund
Kaidah ini menyatakan bahwa elektron akan menempati orbital yang tersedia dengan spin paralel (sejajar) sebelum berpasangan. Dengan kata lain, elektron akan berada di orbital yang berbeda dengan spin yang sama sebelum menempati orbital yang sama dengan pasangan.
Struktur Orbital dalam Mekanika Kuantum
Dalam mekanika kuantum, orbital dibagi menjadi beberapa jenis berdasarkan bentuk dan orientasinya:
– Orbital s: Bentuknya bulat, hanya memiliki satu orbital.
– Orbital p: Berbentuk seperti dumbbell, terdiri dari tiga orbital (px, py, pz).
– Orbital d: Lebih kompleks, terdiri dari lima orbital.
– Orbital f: Paling kompleks, terdiri dari tujuh orbital.
Setiap orbital dapat menampung maksimal dua elektron, dengan arah spin yang berlawanan. Dengan demikian, jumlah maksimum elektron dalam setiap subkulit adalah:
– s = 2
– p = 6
– d = 10
– f = 14
Diagram Orbital dan Konfigurasi Elektron
Diagram orbital adalah alat visual yang digunakan untuk menggambarkan penempatan elektron dalam orbital. Setiap kotak mewakili satu orbital, dan anak panah menunjukkan arah spin elektron. Misalnya, untuk atom oksigen (nomor atom 8), konfigurasinya adalah:
– 1s² 2s² 2p⁴
Diagram orbitalnya akan terlihat seperti ini:
– 1s: [↑↓]
– 2s: [↑↓]
– 2p: [↑↓] [↑] [↑]
Dalam diagram ini, orbital 2p memiliki tiga kotak, dan elektron menyebar ke semua kotak dengan spin sejajar sebelum berpasangan.
Pengaruh Konfigurasi Elektron pada Sifat Kimia
Konfigurasi elektron menentukan sifat kimia suatu atom, terutama golongan dan periode dalam tabel periodik. Elektron valensi (elektron terluar) menentukan kemampuan suatu atom untuk bereaksi dengan atom lain. Misalnya:
– Atom dengan elektron valensi 1 (seperti natrium) cenderung melepaskan elektron.
– Atom dengan elektron valensi 7 (seperti klorin) cenderung menerima elektron.
Selain itu, konfigurasi elektron juga memengaruhi:
– Jari-jari atom
– Energi ionisasi
– Elektronegativitas
– Sifat logam dan non-logam
Penyimpangan dalam Konfigurasi Elektron
Meskipun aturan Aufbau, Pauli, dan Hund umumnya berlaku, terdapat beberapa penyimpangan yang terjadi pada atom-atom tertentu, terutama pada elemen transisi. Contohnya:
– Atom kromium (Cr) memiliki konfigurasi [Ar] 3d⁵ 4s¹, bukan [Ar] 3d⁴ 4s².
– Atom tembaga (Cu) memiliki konfigurasi [Ar] 3d¹⁰ 4s¹, bukan [Ar] 3d⁹ 4s².
Penyimpangan ini terjadi karena konfigurasi yang lebih stabil (seperti setengah penuh atau penuh pada subkulit d) lebih disukai daripada konfigurasi yang tidak seimbang.
Kesimpulan
Konfigurasi elektron dalam mekanika kuantum adalah fondasi untuk memahami struktur atom dan sifat kimia suatu unsur. Dengan mengikuti aturan-aturan seperti Aufbau, Pauli, dan Hund, kita dapat menentukan bagaimana elektron terdistribusi dalam orbital. Pemahaman ini sangat penting dalam bidang kimia, fisika, dan teknologi material, karena membantu menjelaskan interaksi antar atom, pembentukan senyawa, dan sifat-sifat bahan.
Dengan terus berkembangnya ilmu fisika kuantum, konfigurasi elektron tetap menjadi tema sentral dalam studi tentang struktur atom dan perilaku partikel subatomik. Semakin dalam pemahaman kita tentang konfigurasi ini, semakin baik kita dalam memprediksi dan mengontrol sifat-sifat material yang digunakan dalam berbagai aplikasi teknologi modern.


















Komentar