Pengertian dan Prinsip Kerja Notasi Sel Volta dalam Kimia
Dalam dunia kimia, notasi sel volta menjadi salah satu konsep penting yang digunakan untuk menggambarkan reaksi elektrokimia. Notasi ini tidak hanya memberikan informasi tentang komponen-komponen sel volta, tetapi juga menjelaskan arah aliran elektron dan proses oksidasi serta reduksi yang terjadi. Dengan memahami notasi sel volta, kita dapat lebih mudah memahami bagaimana energi kimia diubah menjadi energi listrik melalui reaksi redoks yang spontan.
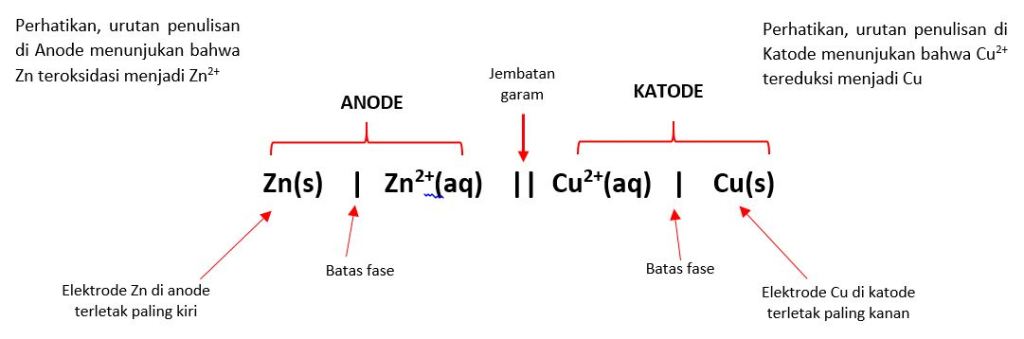
Notasi sel volta merupakan cara penulisan singkat dari suatu reaksi elektrokimia. Penulisan ini menggunakan simbol-simbol khusus untuk menunjukkan anoda (elektroda negatif) dan katoda (elektroda positif), serta larutan elektrolitnya. Contohnya, notasi sel volta antara logam seng (Zn) dan tembaga (Cu) adalah Zn(s)|Zn²⁺(aq)||Cu²⁺(aq)|Cu(s). Dalam notasi ini, tanda vertikal (|) memisahkan logam dan ionnya, sedangkan tanda dua garis vertikal (||) menunjukkan jembatan garam yang menghubungkan kedua setengah sel.
Sel volta memiliki peran penting dalam kehidupan sehari-hari, seperti pada baterai, aki, dan sel bahan bakar. Karena itu, pemahaman tentang notasi sel volta sangat diperlukan untuk memahami prinsip kerja alat-alat tersebut. Selain itu, notasi sel volta juga digunakan dalam studi ilmiah untuk menganalisis potensial elektroda dan reaksi redoks yang terjadi.
Apa Itu Notasi Sel Volta?
Notasi sel volta adalah sistem penulisan yang digunakan untuk menggambarkan struktur dan reaksi dalam sel volta. Sistem ini membantu ilmuwan dan siswa kimia untuk memahami komponen-komponen sel volta secara lebih rinci. Dalam notasi sel volta, setiap elemen memiliki makna spesifik. Misalnya, logam anoda ditulis di sebelah kiri, sedangkan logam katoda ditulis di sebelah kanan. Di antara keduanya, terdapat tanda dua garis vertikal (||) yang menunjukkan adanya jembatan garam. Jembatan garam berfungsi sebagai penghubung antara dua larutan elektrolit agar muatan listrik tetap seimbang.
Notasi sel volta juga mencakup informasi tentang konsentrasi ion dalam larutan. Misalnya, jika ion Zn²⁺ memiliki konsentrasi 1 M, maka akan ditulis sebagai Zn²⁺(aq). Dengan demikian, notasi sel volta tidak hanya menyampaikan informasi tentang komponen sel, tetapi juga kondisi lingkungan di mana reaksi terjadi.
Pemahaman tentang notasi sel volta sangat penting dalam studi elektrokimia. Hal ini karena notasi ini membantu dalam menentukan arah aliran elektron dan potensial elektroda. Dengan mengetahui potensial elektroda, kita dapat memprediksi apakah suatu reaksi akan terjadi secara spontan atau tidak. Selain itu, notasi sel volta juga digunakan dalam pengembangan teknologi seperti baterai dan sel bahan bakar.
Prinsip Kerja Notasi Sel Volta
Prinsip kerja notasi sel volta didasarkan pada reaksi redoks yang terjadi dalam sel volta. Dalam sel volta, terdapat dua setengah sel yang saling terhubung melalui jembatan garam. Setengah sel pertama, yaitu anoda, merupakan tempat terjadinya reaksi oksidasi, sedangkan setengah sel kedua, yaitu katoda, merupakan tempat terjadinya reaksi reduksi. Elektron yang dilepaskan oleh anoda akan mengalir melalui kawat penghantar menuju katoda, sehingga terbentuk arus listrik.
Dalam notasi sel volta, anoda ditulis di sebelah kiri dan katoda di sebelah kanan. Misalnya, notasi sel volta antara logam seng (Zn) dan tembaga (Cu) adalah Zn(s)|Zn²⁺(aq)||Cu²⁺(aq)|Cu(s). Dalam notasi ini, logam seng berperan sebagai anoda, sedangkan logam tembaga berperan sebagai katoda. Reaksi oksidasi yang terjadi pada anoda adalah Zn(s) → Zn²⁺(aq) + 2e⁻, sedangkan reaksi reduksi yang terjadi pada katoda adalah Cu²⁺(aq) + 2e⁻ → Cu(s).
Potensial sel standar (E⁰) adalah ukuran kemampuan suatu sel volta untuk menghasilkan arus listrik. Potensial sel standar dapat dihitung dengan rumus E⁰ = E⁰(katoda) – E⁰(anoda). Jika nilai E⁰ positif, maka reaksi akan terjadi secara spontan. Sebaliknya, jika nilai E⁰ negatif, maka reaksi tidak akan terjadi secara spontan.
Pemahaman tentang prinsip kerja notasi sel volta sangat penting dalam studi elektrokimia. Hal ini karena notasi ini membantu dalam menentukan arah aliran elektron dan potensial elektroda. Dengan mengetahui potensial elektroda, kita dapat memprediksi apakah suatu reaksi akan terjadi secara spontan atau tidak. Selain itu, notasi sel volta juga digunakan dalam pengembangan teknologi seperti baterai dan sel bahan bakar.
Komponen-Komponen dalam Notasi Sel Volta
Dalam notasi sel volta, terdapat beberapa komponen penting yang harus dipahami. Pertama, anoda dan katoda. Anoda adalah elektroda negatif yang merupakan tempat terjadinya reaksi oksidasi, sedangkan katoda adalah elektroda positif yang merupakan tempat terjadinya reaksi reduksi. Kedua elektroda ini terhubung melalui jembatan garam, yang berfungsi sebagai penghubung antara dua larutan elektrolit agar muatan listrik tetap seimbang.
Kedua, larutan elektrolit. Larutan elektrolit merupakan medium di mana reaksi redoks terjadi. Larutan elektrolit biasanya mengandung ion-ion yang dapat bergerak bebas. Contohnya, dalam sel volta yang menggunakan logam seng dan tembaga, larutan elektrolit yang digunakan adalah larutan seng sulfat (ZnSO₄) dan larutan tembaga sulfat (CuSO₄).
Ketiga, jembatan garam. Jembatan garam adalah alat yang digunakan untuk menghubungkan dua larutan elektrolit. Jembatan garam biasanya terbuat dari gel elektrolit yang ditempatkan dalam pipa sempit. Fungsi utama jembatan garam adalah menjaga keseimbangan muatan antara dua larutan elektrolit. Tanpa jembatan garam, muatan listrik akan terakumulasi di salah satu larutan, sehingga reaksi redoks tidak dapat terjadi secara efisien.
Keempat, voltmeter. Voltmeter adalah alat yang digunakan untuk mengukur beda potensial antara anoda dan katoda. Beda potensial ini menunjukkan seberapa besar energi listrik yang dihasilkan oleh sel volta. Dengan menggunakan voltmeter, kita dapat mengetahui apakah suatu reaksi akan terjadi secara spontan atau tidak.
Pemahaman tentang komponen-komponen dalam notasi sel volta sangat penting dalam studi elektrokimia. Hal ini karena komponen-komponen ini membantu dalam menentukan arah aliran elektron dan potensial elektroda. Dengan mengetahui potensial elektroda, kita dapat memprediksi apakah suatu reaksi akan terjadi secara spontan atau tidak. Selain itu, notasi sel volta juga digunakan dalam pengembangan teknologi seperti baterai dan sel bahan bakar.
Contoh Notasi Sel Volta dan Reaksi yang Terjadi
Contoh paling umum dari notasi sel volta adalah sel yang menggunakan logam seng (Zn) dan tembaga (Cu). Dalam notasi sel volta, logam seng ditulis di sebelah kiri dan logam tembaga di sebelah kanan. Notasi lengkapnya adalah Zn(s)|Zn²⁺(aq)||Cu²⁺(aq)|Cu(s). Dalam notasi ini, logam seng berperan sebagai anoda, sedangkan logam tembaga berperan sebagai katoda.
Reaksi oksidasi yang terjadi pada anoda adalah Zn(s) → Zn²⁺(aq) + 2e⁻. Dalam reaksi ini, atom seng melepaskan dua elektron dan berubah menjadi ion Zn²⁺. Elektron-elektron yang dilepaskan ini mengalir melalui kawat penghantar menuju katoda.
Reaksi reduksi yang terjadi pada katoda adalah Cu²⁺(aq) + 2e⁻ → Cu(s). Dalam reaksi ini, ion Cu²⁺ menerima dua elektron dan berubah menjadi atom tembaga. Atom tembaga ini kemudian menempel pada elektroda katoda.
Reaksi total yang terjadi dalam sel volta adalah Zn(s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu(s). Dalam reaksi ini, logam seng bereaksi dengan ion tembaga untuk membentuk ion seng dan logam tembaga. Reaksi ini terjadi secara spontan karena potensial sel standar (E⁰) bernilai positif.
Potensial sel standar (E⁰) dapat dihitung dengan rumus E⁰ = E⁰(katoda) – E⁰(anoda). Dalam contoh ini, E⁰(katoda) adalah potensial reduksi tembaga, yaitu +0,34 V, dan E⁰(anoda) adalah potensial reduksi seng, yaitu -0,76 V. Dengan demikian, E⁰ = 0,34 V – (-0,76 V) = 1,10 V. Nilai E⁰ yang positif menunjukkan bahwa reaksi akan terjadi secara spontan.
Contoh notasi sel volta ini sangat penting dalam studi elektrokimia. Dengan memahami contoh ini, kita dapat lebih mudah memahami bagaimana energi kimia diubah menjadi energi listrik melalui reaksi redoks yang spontan. Selain itu, contoh ini juga membantu dalam memahami prinsip kerja alat-alat seperti baterai dan aki.
Kegunaan Notasi Sel Volta dalam Teknologi
Notasi sel volta memiliki peran penting dalam berbagai teknologi modern. Salah satu contoh paling umum adalah baterai. Baterai bekerja berdasarkan prinsip sel volta, di mana energi kimia diubah menjadi energi listrik melalui reaksi redoks yang spontan. Dalam baterai, anoda dan katoda terdiri dari logam-logam tertentu yang mampu menghasilkan arus listrik saat direaksikan.
Contoh lain dari penggunaan notasi sel volta adalah aki (akumulator). Aki digunakan dalam kendaraan bermotor seperti mobil dan motor. Dalam aki, anoda dan katoda terdiri dari logam timbal (Pb) dan timbal dioksida (PbO₂). Reaksi yang terjadi dalam aki adalah reversibel, artinya aki dapat diisi ulang setelah habis digunakan. Notasi sel volta untuk aki adalah Pb(s)|PbSO₄(aq)||PbO₂(s)|PbSO₄(aq).
Sel bahan bakar juga merupakan contoh penggunaan notasi sel volta. Sel bahan bakar menggunakan gas hidrogen dan oksigen sebagai bahan baku untuk menghasilkan energi listrik. Reaksi yang terjadi dalam sel bahan bakar adalah H₂(g) + ½O₂(g) → H₂O(l). Notasi sel volta untuk sel bahan bakar adalah H₂(g)|H⁺(aq)||O₂(g)|H₂O(l).
Selain baterai, aki, dan sel bahan bakar, notasi sel volta juga digunakan dalam berbagai aplikasi teknologi lainnya, seperti sensor elektrokimia dan sistem penyimpanan energi. Dengan memahami notasi sel volta, kita dapat lebih mudah memahami prinsip kerja alat-alat tersebut dan mengembangkan teknologi baru yang lebih efisien.
Cara Menghitung Potensial Sel Standar
Untuk menghitung potensial sel standar (E⁰), kita dapat menggunakan rumus E⁰ = E⁰(katoda) – E⁰(anoda). Dalam rumus ini, E⁰(katoda) adalah potensial reduksi katoda, sedangkan E⁰(anoda) adalah potensial reduksi anoda. Jika nilai E⁰ positif, maka reaksi akan terjadi secara spontan. Sebaliknya, jika nilai E⁰ negatif, maka reaksi tidak akan terjadi secara spontan.
Sebagai contoh, kita ingin menghitung potensial sel standar untuk sel volta yang menggunakan logam seng (Zn) dan tembaga (Cu). Diketahui bahwa E⁰(katoda) untuk tembaga adalah +0,34 V dan E⁰(anoda) untuk seng adalah -0,76 V. Dengan menggunakan rumus E⁰ = E⁰(katoda) – E⁰(anoda), kita mendapatkan E⁰ = 0,34 V – (-0,76 V) = 1,10 V. Nilai E⁰ yang positif menunjukkan bahwa reaksi akan terjadi secara spontan.
Proses penghitungan potensial sel standar sangat penting dalam studi elektrokimia. Dengan mengetahui potensial sel standar, kita dapat memprediksi apakah suatu reaksi akan terjadi secara spontan atau tidak. Selain itu, potensial sel standar juga digunakan dalam pengembangan teknologi seperti baterai dan sel bahan bakar.
Contoh Soal Mengenai Notasi Sel Volta
Berikut adalah beberapa contoh soal mengenai notasi sel volta yang dapat membantu memperdalam pemahaman Anda:
- Soal 1
Diketahui potensial reduksi standar beberapa logam berikut ini: - Mg²⁺ + 2e⁻ → Mg, E⁰ = -2,35 V
- Cu²⁺ + 2e⁻ → Cu, E⁰ = +0,32 V
- Ag⁺ + e⁻ → Ag, E⁰ = +0,79 V
- Zn²⁺ + 2e⁻ → Zn, E⁰ = -0,78 V
Manakah dari sel berikut yang merupakan sel volta?
a) Mg|Mg²⁺||Cu²⁺|Cu
b) Fe|Fe²⁺||Cu²⁺|Cu
c) Ag|Ag⁺||Cu²⁺|Cu
d) Fe|Fe²⁺||Ag⁺|Ag
e) Mg|Mg²⁺||Fe²⁺|Fe
f) Zn|Zn²⁺||Fe²⁺|Fe
Pembahasan:
Syarat sel volta adalah reaksi harus spontan, ditandai dengan potensial sel yang positif. Rumus E⁰ = E⁰(katoda) – E⁰(anoda) digunakan untuk menghitung potensial sel. Jika E⁰(anoda) < E⁰(katoda), maka reaksi akan spontan. Dengan demikian, yang merupakan sel volta adalah (a), (b), (d), dan (e).
- Soal 2
Jika suatu sel volta menggunakan logam Ag dan Zn, tentukan anoda, katoda, reaksi yang terjadi, notasi, dan potensial selnya! Diketahui potensial reduksi Ag dan Zn sebagai berikut: - Ag⁺ + e⁻ → Ag, E⁰ = +0,79 V
- Zn²⁺ + 2e⁻ → Zn, E⁰ = -0,78 V
Pembahasan:
Anoda memiliki E⁰ lebih kecil, maka Zn adalah anoda dan Ag adalah katoda. Reaksi sel tersebut sebagai berikut:
– Anoda: Zn → Zn²⁺ + 2e⁻
– Katoda: Ag⁺ + e⁻ → Ag
– Reaksi sel: Zn + Ag⁺ → Zn²⁺ + Ag
– Notasi sel: Zn|Zn²⁺||Ag⁺|Ag
– E⁰ sel = E⁰(katoda) – E⁰(anoda) = 0,79 V – (-0,78 V) = 1,57 V
Contoh soal ini menunjukkan bagaimana notasi sel volta dapat digunakan untuk menganalisis reaksi elektrokimia dan menghitung potensial sel standar. Dengan memahami contoh soal ini, kita dapat lebih mudah memahami prinsip kerja sel volta dan aplikasinya dalam teknologi.


















Komentar