Mengenal Sifat-Sifat Periodik Unsur dan Pentingnya dalam Kimia
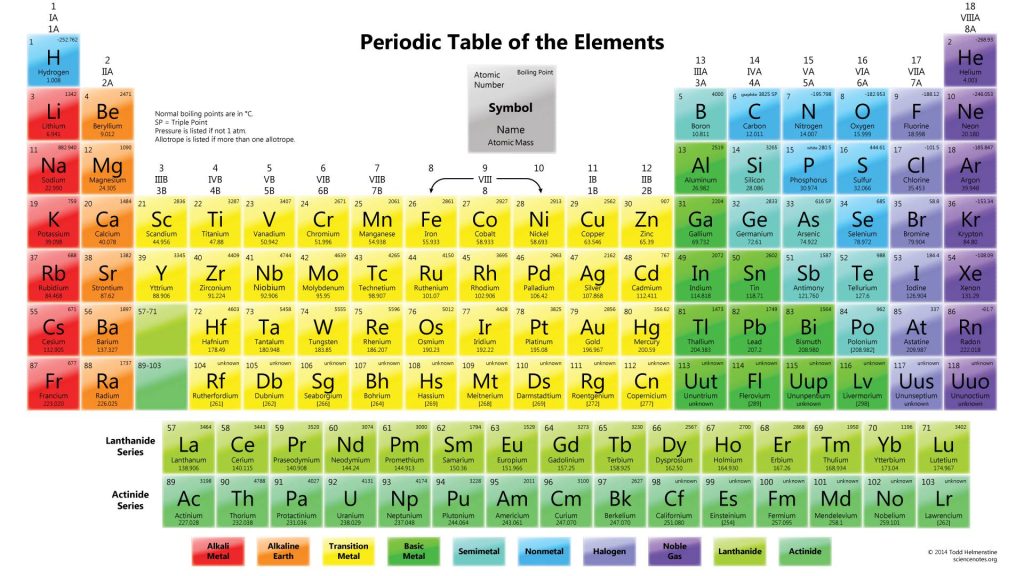
Dalam dunia kimia, tabel periodik merupakan salah satu alat paling penting yang digunakan untuk memahami sifat-sifat unsur dan hubungan antara satu sama lain. Dengan pengelompokan berdasarkan nomor atom dan konfigurasi elektron, tabel ini memberikan wawasan mendalam tentang bagaimana unsur-unsur bereaksi, mengikat, serta memiliki sifat fisika dan kimia tertentu. Salah satu aspek utama dari tabel periodik adalah sifat-sifat periodik unsur, yang mencakup jari-jari atom, energi ionisasi, afinitas elektron, keelektronegatifan, dan sifat logam atau non-logam.
Sifat-sifat periodik tidak hanya membantu dalam memahami struktur atom, tetapi juga menjadi dasar untuk memprediksi reaktivitas dan perilaku kimia suatu unsur. Misalnya, dengan mengetahui posisi suatu unsur dalam tabel periodik, kita dapat memperkirakan apakah ia akan bersifat logam, non-logam, atau semi-logam, serta seberapa mudah ia melepaskan atau menangkap elektron.
Selain itu, pemahaman tentang sifat-sifat periodik sangat penting dalam studi kimia modern, terutama dalam bidang kimia anorganik, kimia organik, dan kimia fisika. Dengan data yang tersedia, ilmuwan dapat merancang senyawa baru, memahami proses reaksi kimia, serta mengembangkan teknologi di berbagai bidang seperti farmasi, material, dan lingkungan.
Artikel ini akan menjelajahi lebih dalam tentang sifat-sifat periodik unsur, termasuk perubahan yang terjadi dalam satu golongan maupun satu periode, serta dampaknya terhadap sifat kimia dan fisika suatu unsur. Kami juga akan membahas contoh-contoh nyata dan aplikasi praktis dari sifat-sifat ini dalam kehidupan sehari-hari dan industri.
Apa Itu Sifat-Sifat Periodik Unsur?
Sifat-sifat periodik unsur merujuk pada karakteristik atau ciri-ciri khas yang dimiliki oleh unsur-unsur kimia, yang berubah secara teratur sesuai dengan peningkatan nomor atom. Perubahan ini terlihat dalam bentuk pola-pola yang konsisten, baik dalam satu golongan (vertikal) maupun satu periode (horizontal) dalam tabel periodik.
Beberapa contoh sifat-sifat periodik yang paling umum meliputi:
- Jari-jari atom
- Energi ionisasi
- Afinitas elektron
- Keelektronegatifan
- Sifat logam dan non-logam
- Kereaktifan
Setiap sifat ini memiliki tren atau pola yang dapat diprediksi, sehingga memudahkan para ilmuwan dan siswa dalam memahami dan mempelajari sifat-sifat kimia suatu unsur.
1. Jari-Jari Atom
Jari-jari atom adalah jarak dari inti atom hingga kulit elektron terluar. Sifat ini sangat penting karena mempengaruhi kemampuan suatu atom untuk bereaksi dengan atom lain.
Pola dalam Tabel Periodik:
- Dalam satu golongan (vertikal): Jari-jari atom semakin besar dari atas ke bawah. Hal ini disebabkan oleh penambahan kulit elektron.
- Dalam satu periode (horizontal): Jari-jari atom semakin kecil dari kiri ke kanan. Penyebabnya adalah meningkatnya muatan inti efektif, yang membuat elektron terluar lebih kuat ditarik ke inti.
Contoh:
– Litium (Li) memiliki jari-jari atom lebih kecil daripada natrium (Na), yang lebih kecil daripada kalium (K).
– Karbon (C) memiliki jari-jari atom lebih kecil daripada nitrogen (N), yang lebih kecil daripada oksigen (O).
2. Energi Ionisasi
Energi ionisasi adalah jumlah energi yang dibutuhkan untuk melepaskan satu elektron dari atom netral dalam fase gas. Semakin tinggi energi ionisasi, semakin sulit elektron dilepaskan.
Pola dalam Tabel Periodik:
- Dalam satu golongan: Energi ionisasi menurun dari atas ke bawah. Elektron terluar semakin jauh dari inti, sehingga lebih mudah dilepaskan.
- Dalam satu periode: Energi ionisasi meningkat dari kiri ke kanan. Muatan inti efektif meningkat, sehingga gaya tarik inti terhadap elektron terluar makin kuat.
Contoh:
– Energi ionisasi natrium (Na) lebih rendah daripada magnesium (Mg), yang lebih rendah daripada aluminium (Al).
– Energi ionisasi lithium (Li) lebih rendah daripada boron (B), yang lebih rendah daripada karbon (C).
3. Afinitas Elektron
Afinitas elektron adalah energi yang dilepaskan atau diserap saat suatu atom menerima elektron. Ini menunjukkan seberapa mudah suatu atom menangkap elektron.
Pola dalam Tabel Periodik:
- Dalam satu golongan: Afinitas elektron biasanya menurun dari atas ke bawah. Elektron terluar semakin jauh dari inti, sehingga daya tarik inti berkurang.
- Dalam satu periode: Afinitas elektron biasanya meningkat dari kiri ke kanan, terutama pada golongan VIIA (halogen).
Contoh:
– Afinitas elektron fluor (F) lebih tinggi daripada klorin (Cl), yang lebih tinggi daripada bromin (Br).
– Afinitas elektron oksigen (O) lebih tinggi daripada belerang (S), yang lebih tinggi daripada selenium (Se).
4. Keelektronegatifan
Keelektronegatifan adalah kemampuan suatu atom untuk menarik pasangan elektron dalam ikatan kimia. Skala Pauling sering digunakan untuk mengukur nilai ini.
Pola dalam Tabel Periodik:
- Dalam satu golongan: Keelektronegatifan menurun dari atas ke bawah. Elektron terluar semakin jauh dari inti, sehingga daya tarik inti berkurang.
- Dalam satu periode: Keelektronegatifan meningkat dari kiri ke kanan. Elektron terluar semakin dekat dengan inti, sehingga daya tarik inti meningkat.
Contoh:
– Keelektronegatifan fluor (F) lebih tinggi daripada klorin (Cl), yang lebih tinggi daripada bromin (Br).
– Keelektronegatifan litium (Li) lebih rendah daripada boron (B), yang lebih rendah daripada karbon (C).
5. Sifat Logam dan Non-Logam
Sifat logam dan non-logam berkaitan dengan kemampuan suatu atom untuk melepaskan atau menangkap elektron.
Pola dalam Tabel Periodik:
- Dalam satu golongan: Sifat logam meningkat dari atas ke bawah. Elektron terluar semakin mudah dilepaskan.
- Dalam satu periode: Sifat logam menurun dari kiri ke kanan. Elektron terluar semakin sulit dilepaskan.
Contoh:
– Logam alkali (seperti Na dan K) sangat reaktif dan mudah melepaskan elektron.
– Unsur halogen (seperti F dan Cl) sangat reaktif dan mudah menangkap elektron.
6. Kereaktifan
Kereaktifan menggambarkan seberapa mudah suatu unsur bereaksi dengan unsur lain.
Pola dalam Tabel Periodik:
- Unsur logam: Kereaktifan meningkat dari atas ke bawah. Contoh: Na < K < Rb.
- Unsur non-logam: Kereaktifan menurun dari atas ke bawah. Contoh: F > Cl > Br > I.
Contoh:
– Unsur logam golongan IA (seperti Li, Na, K) sangat reaktif dan bereaksi cepat dengan air.
– Unsur non-logam golongan VIIA (seperti F, Cl, Br) sangat reaktif dan membentuk senyawa stabil dengan logam.
Kesimpulan
Sifat-sifat periodik unsur adalah fondasi penting dalam memahami sifat kimia dan fisika suatu unsur. Dengan memahami pola-pola yang terjadi dalam tabel periodik, kita dapat memprediksi reaktivitas, sifat logam atau non-logam, serta cara suatu unsur berinteraksi dengan unsur lain. Pemahaman ini tidak hanya berguna dalam studi kimia, tetapi juga dalam pengembangan teknologi, obat-obatan, dan material baru.
Pemahaman tentang sifat-sifat periodik juga membantu dalam merancang senyawa kimia yang sesuai dengan kebutuhan industri dan penelitian. Dengan demikian, sifat-sifat periodik tidak hanya sekadar teori, tetapi memiliki implikasi nyata dalam kehidupan sehari-hari.


















Komentar