Mol adalah konsep dasar dalam ilmu kimia yang digunakan untuk mengukur jumlah partikel dalam suatu zat. Dalam kehidupan sehari-hari, kita sering menggunakan satuan seperti lusin atau kodi untuk menghitung jumlah benda. Namun, dalam kimia, karena partikel-partikel seperti atom, molekul, atau ion sangat kecil dan tidak bisa dihitung satu per satu, maka diperlukan satuan khusus bernama “mol”.
Konsep mol memudahkan kita untuk mengetahui jumlah partikel dalam suatu zat tanpa harus menghitungnya secara manual. Satu mol setara dengan 6,02 x 10^23 partikel, yang disebut sebagai bilangan Avogadro. Dengan demikian, jika kita memiliki 1 mol zat, berarti kita memiliki 6,02 x 10^23 partikel zat tersebut.
Dalam artikel ini, kita akan membahas secara rinci bagaimana cara menghitung mol menggunakan rumus-rumus yang mudah dipahami. Kami juga akan memberikan contoh soal dan penjelasan lengkap agar Anda dapat memahami konsep ini dengan lebih baik. Mari mulai dengan pengertian dasar tentang mol, kemudian lanjutkan dengan rumus-rumus yang digunakan dalam perhitungan mol.
Mol merupakan salah satu konsep penting dalam kimia yang digunakan untuk menyatakan jumlah partikel dalam suatu zat. Konsep ini sangat berguna dalam stoikiometri, yaitu studi tentang hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia. Dengan menggunakan mol, kita dapat menghitung jumlah partikel, massa, volume, atau konsentrasi suatu zat secara akurat.
Selain itu, mol juga digunakan untuk menentukan hubungan antara massa zat dan jumlah partikelnya. Misalnya, jika kita tahu massa molar suatu zat, kita dapat menghitung jumlah mol dari zat tersebut. Sebaliknya, jika kita tahu jumlah mol, kita juga dapat menentukan massa zat yang sesuai.
Dalam artikel ini, kami akan menjelaskan berbagai rumus yang digunakan dalam perhitungan mol, termasuk rumus hubungan antara jumlah mol, massa, volume, dan jumlah partikel. Kami juga akan memberikan contoh soal beserta penyelesaiannya agar Anda dapat mempraktikkan konsep-konsep yang telah dibahas.
Mari kita mulai dengan pengertian dasar tentang mol dan bagaimana cara menghitungnya menggunakan rumus-rumus yang tepat.
Pengertian Mol dalam Kimia
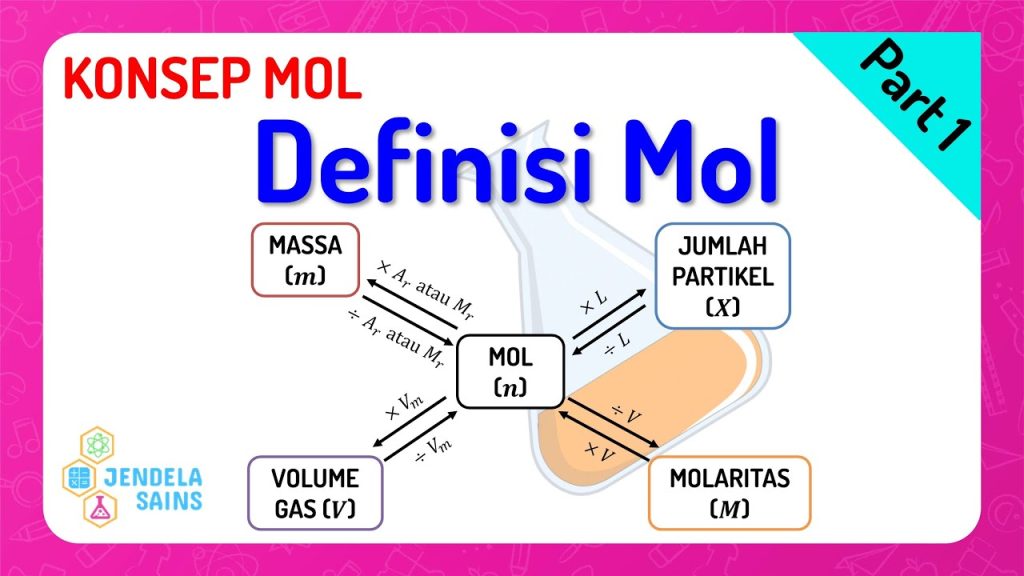
Mol adalah satuan yang digunakan dalam ilmu kimia untuk mengukur jumlah partikel dalam suatu zat. Partikel tersebut bisa berupa atom, molekul, ion, atau elektron. Konsep mol sangat penting dalam kimia karena memungkinkan kita untuk menghitung jumlah partikel dalam suatu zat tanpa harus menghitungnya satu per satu.
Satu mol didefinisikan sebagai jumlah partikel yang terkandung dalam 12 gram karbon-12 (C-12). Jumlah partikel ini disebut sebagai bilangan Avogadro, yang bernilai 6,02 x 10^23. Dengan kata lain, satu mol zat mengandung 6,02 x 10^23 partikel. Bilangan Avogadro ini dinamakan sesuai dengan nama ilmuwan yang pertama kali menghitungnya, yaitu Amedeo Avogadro.
Karena partikel-partikel dalam suatu zat sangat kecil dan tidak bisa dihitung secara langsung, konsep mol menjadi alat yang sangat berguna dalam kimia. Dengan menggunakan mol, kita dapat menentukan jumlah partikel dalam suatu zat, serta hubungan antara jumlah mol, massa, dan volume zat tersebut.
Misalnya, jika kita memiliki 1 mol air (H2O), maka kita memiliki 6,02 x 10^23 molekul air. Setiap molekul air terdiri dari dua atom hidrogen dan satu atom oksigen, sehingga dalam 1 mol air terdapat 1,204 x 10^24 atom hidrogen dan 6,02 x 10^23 atom oksigen.
Dengan memahami konsep mol, kita dapat melakukan perhitungan kuantitatif dalam reaksi kimia, larutan, dan gas ideal. Oleh karena itu, pemahaman tentang mol sangat penting bagi siswa dan praktisi kimia.
Rumus Mencari Mol dalam Kimia
Dalam kimia, terdapat beberapa rumus yang digunakan untuk menghitung jumlah mol suatu zat. Berikut ini adalah beberapa rumus utama yang sering digunakan:
- Rumus Jumlah Mol Berdasarkan Massa
Jumlah mol suatu zat dapat dihitung dengan membagi massa zat dengan massa molar zat tersebut.
$$
n = \frac{m}{M}
$$
Keterangan: - $n$ = jumlah mol
- $m$ = massa zat (dalam gram)
-
$M$ = massa molar zat (dalam gram/mol)
-
Rumus Jumlah Mol Berdasarkan Jumlah Partikel
Jumlah mol suatu zat juga dapat dihitung dengan membagi jumlah partikel dengan bilangan Avogadro.
$$
n = \frac{N}{L}
$$
Keterangan: - $n$ = jumlah mol
- $N$ = jumlah partikel
-
$L$ = bilangan Avogadro ($6,02 \times 10^{23}$)
-
Rumus Jumlah Mol Berdasarkan Volume Gas
Untuk gas, jumlah mol dapat dihitung dengan membagi volume gas dengan volume molar gas pada kondisi tertentu.
$$
n = \frac{V}{Vm}
$$
Keterangan: - $n$ = jumlah mol
- $V$ = volume gas (dalam liter)
-
$Vm$ = volume molar gas (dalam liter/mol)
-
Rumus Massa Molar
Massa molar adalah massa 1 mol zat. Massa molar dapat dihitung dengan menjumlahkan massa atom relatif (Ar) dari setiap unsur penyusun zat tersebut.
$$
M = \sum (\text{Ar} \times \text{jumlah atom})
$$ -
Rumus Volume Molar Gas
Volume molar gas adalah volume 1 mol gas pada suhu dan tekanan tertentu. Pada keadaan standar (STP), volume molar gas adalah 22,4 liter/mol.
$$
Vm = 22,4 \, \text{liter/mol}
$$ -
Rumus Hubungan Mol dengan Konsentrasi Larutan
Konsentrasi larutan dapat dihitung dengan membagi jumlah mol zat terlarut dengan volume larutan.
$$
C = \frac{n}{V}
$$
Keterangan: - $C$ = konsentrasi larutan (dalam mol/L)
- $n$ = jumlah mol zat terlarut
-
$V$ = volume larutan (dalam liter)
-
Rumus Perhitungan Mol dalam Reaksi Kimia
Dalam reaksi kimia, jumlah mol zat pereaksi dan produk dapat ditentukan melalui koefisien reaksi.
$$
n_{\text{produk}} = n_{\text{reaktan}} \times \frac{\text{koefisien produk}}{\text{koefisien reaktan}}
$$ -
Rumus Hubungan Mol dengan Tekanan dan Suhu Gas
Jika kondisi gas tidak pada STP, volume molar gas dapat dihitung menggunakan hukum gas ideal.
$$
PV = nRT
$$
Keterangan: - $P$ = tekanan gas (dalam atm)
- $V$ = volume gas (dalam liter)
- $n$ = jumlah mol gas
- $R$ = konstanta gas ideal ($0,082 \, \text{L·atm/mol·K}$)
- $T$ = suhu gas (dalam Kelvin)
Dengan memahami dan mengaplikasikan rumus-rumus di atas, kita dapat menghitung jumlah mol suatu zat dengan mudah dan akurat. Selanjutnya, mari kita lihat contoh soal yang akan membantu memperkuat pemahaman kita tentang rumus mencari mol.
Contoh Soal Menghitung Mol
Berikut ini adalah beberapa contoh soal yang akan membantu Anda memahami bagaimana menghitung mol menggunakan rumus-rumus yang telah dibahas sebelumnya.
Contoh Soal 1
Soal:
Berapa jumlah mol dari 24 gram oksigen (O₂)?
Penyelesaian:
Langkah 1: Hitung massa molar O₂.
$$
M = (2 \times Ar \, O) = (2 \times 16) = 32 \, \text{gram/mol}
$$
Langkah 2: Gunakan rumus jumlah mol berdasarkan massa.
$$
n = \frac{m}{M} = \frac{24}{32} = 0,75 \, \text{mol}
$$
Jadi, jumlah mol oksigen adalah 0,75 mol.
Contoh Soal 2
Soal:
Berapa jumlah partikel dalam 2 mol air (H₂O)?
Penyelesaian:
Gunakan rumus jumlah mol berdasarkan jumlah partikel.
$$
N = n \times L = 2 \times 6,02 \times 10^{23} = 1,204 \times 10^{24} \, \text{partikel}
$$
Jadi, jumlah partikel dalam 2 mol air adalah 1,204 × 10²⁴ partikel.
Contoh Soal 3
Soal:
Berapa volume dari 3 mol gas nitrogen (N₂) pada keadaan standar (STP)?
Penyelesaian:
Gunakan rumus jumlah mol berdasarkan volume gas.
$$
V = n \times Vm = 3 \times 22,4 = 67,2 \, \text{liter}
$$
Jadi, volume gas nitrogen adalah 67,2 liter.
Contoh Soal 4
Soal:
Berapa konsentrasi larutan NaCl jika terdapat 0,5 mol NaCl dalam 2 liter larutan?
Penyelesaian:
Gunakan rumus hubungan mol dengan konsentrasi larutan.
$$
C = \frac{n}{V} = \frac{0,5}{2} = 0,25 \, \text{mol/L}
$$
Jadi, konsentrasi larutan NaCl adalah 0,25 mol/L.
Contoh Soal 5
Soal:
Berapa jumlah mol dari 3,01 × 10²³ partikel logam tembaga (Cu)?
Penyelesaian:
Gunakan rumus jumlah mol berdasarkan jumlah partikel.
$$
n = \frac{N}{L} = \frac{3,01 \times 10^{23}}{6,02 \times 10^{23}} = 0,5 \, \text{mol}
$$
Jadi, jumlah mol logam tembaga adalah 0,5 mol.
Dengan mengerjakan contoh soal-soal di atas, kita dapat melatih kemampuan kita dalam menghitung mol menggunakan berbagai rumus yang tersedia. Dengan latihan yang cukup, kita akan semakin mahir dalam menghadapi soal-soal kimia yang berkaitan dengan mol.
Tips dan Trik Menghitung Mol dengan Efisien
Menghitung mol dalam kimia membutuhkan pemahaman yang baik tentang rumus-rumus dasar dan keahlian dalam menerapkannya. Berikut ini adalah beberapa tips dan trik yang dapat membantu Anda menghitung mol dengan lebih efisien dan akurat:
-
Pahami Konsep Dasar Mol
Sebelum memulai perhitungan, pastikan Anda memahami apa itu mol dan bagaimana hubungannya dengan jumlah partikel, massa, dan volume. Hal ini akan membantu Anda dalam memilih rumus yang tepat untuk setiap jenis soal. -
Gunakan Bilangan Avogadro dengan Benar
Bilangan Avogadro ($6,02 \times 10^{23}$) digunakan untuk menghitung jumlah partikel dalam suatu zat. Pastikan Anda menggunakannya dengan benar dalam rumus $n = \frac{N}{L}$. -
Hitung Massa Molar dengan Akurat
Massa molar adalah jumlah massa dari semua atom dalam suatu senyawa. Pastikan Anda menjumlahkan massa atom relatif (Ar) dari setiap unsur dengan benar. Contohnya, untuk H₂O, massa molar adalah $(2 \times 1) + (1 \times 16) = 18 \, \text{gram/mol}$. -
Perhatikan Kondisi Gas
Jika Anda menghitung volume gas, pastikan apakah kondisinya berada pada keadaan standar (STP) atau tidak. Jika tidak, gunakan hukum gas ideal $PV = nRT$ untuk perhitungan yang lebih akurat. -
Gunakan Koefisien Reaksi dalam Reaksi Kimia
Dalam reaksi kimia, jumlah mol zat pereaksi dan produk dapat ditentukan melalui koefisien reaksi. Pastikan Anda memahami bagaimana koefisien reaksi bekerja dalam perhitungan stoikiometri. -
Latihan Terus-Menerus
Latihan adalah kunci dalam menguasai konsep mol. Semakin banyak soal yang Anda kerjakan, semakin baik pemahaman Anda tentang rumus-rumus yang digunakan. -
Gunakan Alat Bantu Seperti Kalkulator atau Tabel Periodik
Jika memungkinkan, gunakan kalkulator untuk mempercepat perhitungan dan tabel periodik untuk mengetahui massa atom relatif (Ar) dari setiap unsur. -
Baca Soal Secara Teliti
Pastikan Anda memahami soal dengan benar sebelum memulai perhitungan. Kadang, soal-soal kimia menyembunyikan informasi penting yang harus Anda identifikasi terlebih dahulu.
Dengan menerapkan tips dan trik di atas, Anda akan lebih mudah dalam menghitung mol dan menghindari kesalahan yang umum terjadi. Selalu ingat bahwa latihan dan pemahaman yang mendalam adalah kunci keberhasilan dalam menguasai konsep mol.


















Komentar